Автор: Денис Аветисян
Новый подход к планированию лучевой терапии позволяет учитывать индивидуальные риски пациента и оптимизировать лечение с учетом как целевого покрытия опухоли, так и минимизации побочных эффектов.
"Покупай на слухах, продавай на новостях". А потом сиди с акциями никому не известной биотех-компании. Здесь мы про скучный, но рабочий фундаментал.
Бесплатный Телеграм канал
Предложена методика многокритериальной оптимизации для планирования радиотерапии с интеграцией моделей оценки рисков и поиском Парето-оптимальных решений.
Несмотря на эффективность многокритериальной оптимизации в планировании лучевой терапии, она часто игнорирует индивидуальные биологические риски пациентов, что может негативно сказаться на результатах лечения. В работе «Bi-level Multi-criteria Optimization for Risk-informed Radiotherapy» предложен новый подход, объединяющий многокритериальную оптимизацию с клиническими моделями риска, позволяющий интерактивно балансировать между дозиметрическими параметрами и прогнозом биологических последствий. Показано, что предложенный метод снижает риск развития радиационного пневмонита, сохраняя при этом адекватное покрытие опухоли. Возможно ли дальнейшее совершенствование персонализированного планирования лучевой терапии за счет интеграции более сложных моделей прогнозирования рисков и индивидуальных особенностей пациентов?
Баланс между эффективностью и безопасностью: Основы лучевой терапии
В лечении немелкоклеточного рака легких (НМРЛ) с помощью лучевой терапии ключевым аспектом является точное нацеливание на клинический целевой объем (КТО), представляющий собой опухоль и близлежащие лимфатические узлы. Однако, эта задача осложняется необходимостью минимизировать дозу облучения, получаемую здоровыми органами и тканями, находящимися вблизи опухоли — легкими, сердцем, пищеводом и другими. Достижение оптимального баланса между эффективным уничтожением злокачественных клеток в КТО и сохранением функциональности окружающих тканей является определяющим фактором успешности лечения и качества жизни пациента. В связи с этим, современные методы планирования лучевой терапии направлены на максимально точное определение границ КТО и органов риска, а также на разработку индивидуального плана облучения, учитывающего анатомические особенности каждого пациента и характеристики опухоли.
Планирование лучевой терапии традиционно сопряжено со сложной задачей одновременной оптимизации множества противоречивых целей дозирования. Каждый объем мишени — как клинический целевой объем (CTV), так и окружающие органы, подверженные риску (OAR) — требует индивидуального подхода к дозировке. Увеличение дозы для обеспечения эффективного уничтожения опухоли часто неизбежно приводит к повышению дозы, получаемой здоровыми тканями, что увеличивает вероятность развития побочных эффектов. Таким образом, поиск оптимального баланса между максимальным воздействием на опухоль и минимальным повреждением окружающих тканей представляет собой серьезную проблему, требующую тщательного анализа и точного планирования. Эффективное решение этой задачи критически важно для достижения наилучших результатов лечения и улучшения качества жизни пациентов.
Успешное преодоление этой сложности в лучевой терапии имеет решающее значение для достижения максимальной вероятности контроля опухоли TCP и одновременного снижения риска развития осложнений в здоровых тканях NTCP. Достижение оптимального баланса между эффективным воздействием на опухоль и сохранением функциональности окружающих органов требует тщательного планирования и индивидуального подхода к каждому пациенту. Недостаточное дозирование может привести к рецидиву заболевания, в то время как избыточное — к серьезным побочным эффектам, ухудшающим качество жизни. Поэтому, оптимизация лучевой терапии направлена на максимизацию TCP при минимизации NTCP, что является ключевым фактором в повышении эффективности лечения и улучшении прогноза для пациентов с немелкоклеточным раком легкого.
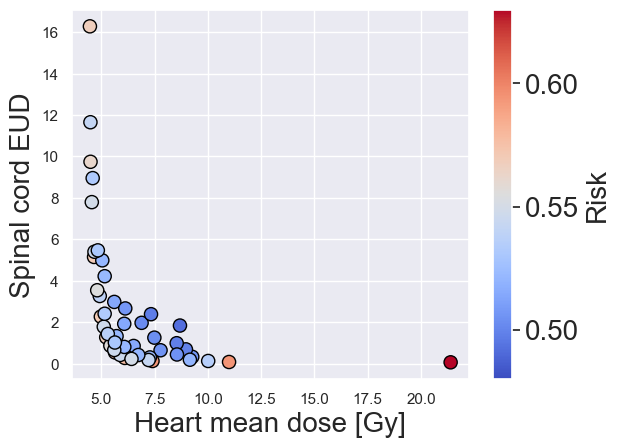
Многокритериальная оптимизация: Эффективный инструмент планирования
Многокритериальная оптимизация (МКО) представляет собой надежный подход к планированию лучевой терапии, который явно учитывает и решает множество целей одновременно. Традиционное планирование часто сосредотачивается на оптимизации одной цели, например, максимального покрытия опухоли, что может привести к ухудшению других важных параметров, таких как доза, получаемая здоровыми тканями. В отличие от этого, МКО позволяет одновременно оптимизировать несколько целей, таких как максимизация дозы в опухоли, минимизация дозы в органах риска и обеспечение соответствия дозы заданным ограничениям. Это достигается путем формулирования задачи планирования как многоцелевой оптимизационной задачи, где каждая цель представлена отдельной функцией, которую необходимо оптимизировать. Использование МКО позволяет получить компромиссные решения, наилучшим образом отвечающие клиническим требованиям и предпочтениям врача.
В рамках многокритериальной оптимизации (MCO) для генерации набора Парето-оптимальных планов используются методы, такие как алгоритм «сэндвича» (Sandwiching Algorithm) и скаляризация взвешенной суммы (Weighted Sum Scalarization). Алгоритм «сэндвича» последовательно формирует планы, оптимизируя по одному критерию, а затем ограничивая его, чтобы найти компромиссные решения. Скаляризация взвешенной суммы, напротив, объединяет несколько критериев в единую скалярную функцию, используя весовые коэффициенты, которые позволяют управлять приоритетами. Изменяя эти веса, можно получить различные Парето-оптимальные планы, представляющие разные комбинации между достижением целей по покрытию опухоли и снижению дозы на органы риска. Оба метода позволяют исследовать пространство решений и выбрать наиболее подходящий план, учитывая клинические требования и предпочтения.
Полученные в ходе многокритериальной оптимизации планы лечения демонстрируют различные компромиссы между максимальным охватом опухоли и минимизацией дозы в критические органы. Эти компромиссы визуализируются с помощью дозово-объемных гистограмм (DVH), которые отображают распределение дозы по различным объемам тканей. Анализ DVH позволяет оценить, насколько хорошо план лечения обеспечивает необходимое покрытие опухоли, одновременно ограничивая воздействие на здоровые ткани, и выбрать наиболее подходящий план, учитывая клинические приоритеты и индивидуальные особенности пациента. Различные планы, представленные в виде Pareto-оптимальных решений, позволяют врачу-радиотерапевту выбрать наиболее приемлемый вариант, основываясь на предпочтительном балансе между эффективностью лечения и снижением риска побочных эффектов.
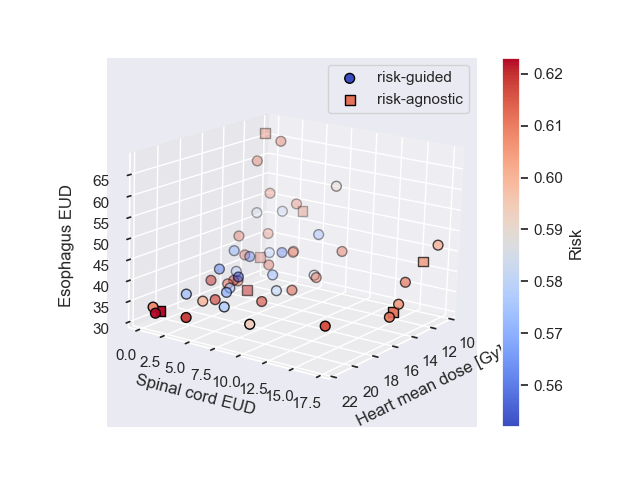
Приоритетная оптимизация: Забота о безопасности пациента
Вторичная оптимизация приоритетов (Secondary Priority Optimization) является расширением подхода MCO (Multi-Criteria Optimization), позволяющим установить иерархический порядок для целевых доз, с акцентом на минимизацию риска для органов, подверженных воздействию радиации. В отличие от стандартного MCO, где все критерии равнозначны, вторичная оптимизация позволяет задать приоритеты, например, снизить вероятность развития радиационного пневмонита (RP) даже за счет незначительного компромисса в обеспечении полного покрытия опухоли. Такой подход обеспечивает более гибкую настройку планов лучевой терапии, ориентированных на снижение вероятности критических осложнений.
Оптимизация вторичного приоритета достигается за счет использования модели риска для прогнозирования вероятности развития радиационного пневмонита (РП), серьезного осложнения при лечении рака легкого. Данная модель оценивает индивидуальный риск возникновения РП для каждого пациента на основе характеристик плана облучения и клинических данных. Прогнозирование вероятности РП позволяет иерархически расставлять приоритеты при оптимизации плана лечения, отдавая предпочтение планам с минимальной вероятностью развития этого осложнения, даже если это влечет за собой незначительное снижение охвата опухоли. Использование модели риска обеспечивает количественную оценку потенциального риска для органов, подвергающихся облучению, что способствует более обоснованному принятию решений в процессе планирования лучевой терапии.
В ходе исследования, проведенного на группе из 19 пациентов, применение метода оптимизации вторичных приоритетов позволило снизить средний риск развития радиационного пневмонита (РП) на 7.73%. При этом, для достижения минимизации риска РП допускалось незначительное снижение степени покрытия опухоли. В частности, зафиксировано среднее снижение объема легких, получающих дозу 5 Гр (V5), на 9.48% для правого легкого и снижение объема легких, получающих дозу 20 Гр (V20), на 7.97% для общего объема легких. Данные результаты демонстрируют эффективность данного подхода в улучшении профиля безопасности лучевой терапии.
К адаптивному планированию и за его пределы: Взгляд в будущее
Интеграция прогнозирования рисков во вторичную оптимизацию представляет собой перспективный путь к действительно адаптивному планированию лечения. Данный подход позволяет учитывать индивидуальные факторы риска пациента и динамически корректировать процесс оптимизации на основе текущего ответа на терапию. Вместо использования стандартных, универсальных планов, лечение формируется с учетом вероятности развития осложнений у конкретного пациента, что позволяет минимизировать потенциальные негативные последствия и максимизировать эффективность терапии. Такая адаптивность особенно важна при лечении немелкоклеточного рака легкого, где индивидуальные характеристики опухоли и пациента существенно влияют на исход лечения. В результате, возможно не только улучшение показателей выживаемости, но и значительное повышение качества жизни пациентов.
Оптимизация лучевой терапии, в настоящее время, способна динамически адаптироваться к индивидуальным особенностям пациента и изменениям, происходящим в процессе лечения. Внедрение данных о специфических факторах риска, таких как сопутствующие заболевания, общее состояние здоровья и характеристики опухоли, позволяет создать персонализированный план лечения. При этом, непрерывный мониторинг ответа на терапию, осуществляемый с помощью современных методов визуализации и биомаркеров, обеспечивает возможность корректировки плана в режиме реального времени. Такой подход позволяет не только максимизировать эффективность воздействия на опухоль, но и минимизировать потенциальные побочные эффекты, существенно улучшая качество жизни пациента на протяжении всего курса лечения и после него.
Применение адаптивной стратегии планирования лучевой терапии демонстрирует значительный потенциал в снижении частоты осложнений у пациентов с немелкоклеточным раком легкого. За счет индивидуального учета факторов риска и непрерывного мониторинга ответа на лечение, возможно динамическое изменение плана облучения, что позволяет минимизировать воздействие на здоровые ткани и максимизировать эффективность терапии. Подобный подход направлен не только на увеличение выживаемости, но и на существенное улучшение качества жизни пациентов, позволяя им сохранять функциональность и снижать связанные с лечением побочные эффекты. Ожидается, что адаптивное планирование станет ключевым элементом в повышении общей результативности лучевой терапии при немелкоклеточном раке легкого, предлагая более персонализированный и эффективный подход к лечению.
![Сравнение распределения дозы при использовании подхода, не учитывающего риски, и четырех планов, учитывающих риски, показывает, что последний позволяет снизить дозу в критических органах, таких как легкие, сердце и спинной мозг, при сохранении покрытия опухоли [latex]CTV[/latex] и [latex]PTV[/latex].](https://arxiv.org/html/2601.04821v1/figures/dose_maps/Plan4-RA.png)
Исследование демонстрирует стремление к созданию целостной системы планирования лучевой терапии, где оптимизация дозы и минимизация рисков рассматриваются не как отдельные задачи, а как взаимосвязанные элементы единого процесса. Авторы подчеркивают важность учета индивидуальных рисков пациента, что согласуется с принципом структурирования поведения системы через понимание её внутренних взаимодействий. В этой связи, замечательно подходит высказывание Вильгельма Рентгена: «Я не знаю, что это такое, но это что-то новое». В данном исследовании, подобно открытию Рентгена, предлагается новый подход к планированию лечения, позволяющий взглянуть на проблему под иным углом и добиться более эффективных результатов, учитывая сложные биологические факторы и индивидуальные особенности каждого пациента.
Куда Ведет Этот Путь?
Представленная методика, стремясь к балансу между эффективностью лучевой терапии и минимизацией рисков, неизбежно наталкивается на сложность самой биологической системы. Каждая новая зависимость от индивидуальных моделей риска, хоть и повышает точность, несет в себе скрытую цену — увеличение вычислительной нагрузки и потенциальную чувствительность к неточностям исходных данных. Элегантность решения заключается не в усложнении, а в поиске минимально достаточного набора параметров, определяющих поведение системы.
Дальнейшее развитие, вероятно, потребует смещения фокуса с оптимизации отдельных критериев на исследование самой структуры взаимосвязей между ними. Достижение «оптимальности по Парето» — лишь промежуточный этап; истинная задача заключается в понимании, как изменения в архитектуре плана лечения влияют на общую устойчивость системы к неблагоприятным факторам. Необходимо учитывать, что любая модель — это упрощение реальности, и ее точность всегда ограничена.
Будущие исследования должны сосредоточиться на разработке адаптивных алгоритмов, способных учитывать динамические изменения в биологическом статусе пациента в процессе лечения. Поиск универсального решения, вероятно, иллюзорен; истинный прогресс заключается в создании гибких систем, способных адаптироваться к индивидуальным особенностям каждого пациента, признавая, что идеальная система — это не застывшая конструкция, а живой организм.
Оригинал статьи: https://arxiv.org/pdf/2601.04821.pdf
Связаться с автором: https://www.linkedin.com/in/avetisyan/
Смотрите также:
- Капитал Б&Т и его душа в AESI
- Почему акции Pool Corp могут стать привлекательным выбором этим летом
- Стоит ли покупать фунты за йены сейчас или подождать?
- Квантовые Химеры: Три Способа Не Потерять Рубль
- Два актива, которые взорвут финансовый Лас-Вегас к 2026
- МКБ акции прогноз. Цена CBOM
- Один потрясающий рост акций, упавший на 75%, чтобы купить во время падения в июле
- Будущее ONDO: прогноз цен на криптовалюту ONDO
- Делимобиль акции прогноз. Цена DELI
- Российский рынок: Рост на фоне Ближнего Востока и сырьевая уверенность на 100 лет (28.02.2026 10:32)
2026-01-10 00:46